- A pesquisa bibliográfica deve ser realizada conforme uma estratégia explícita;
- A seleção das evidências deve ser documentada e basear-se em critérios de inclusão e exclusão definidos;
- Os estudos incluídos devem ser analisados criticamente.
- Guias já desenvolvidos e publicados por outras instituições, que contenham recomendações que se ajustam às perguntas propostas pelo painel;
- Revisões sistemáticas existentes para complementar àquelas perguntas clínicas para as quais inexistem recomendações.
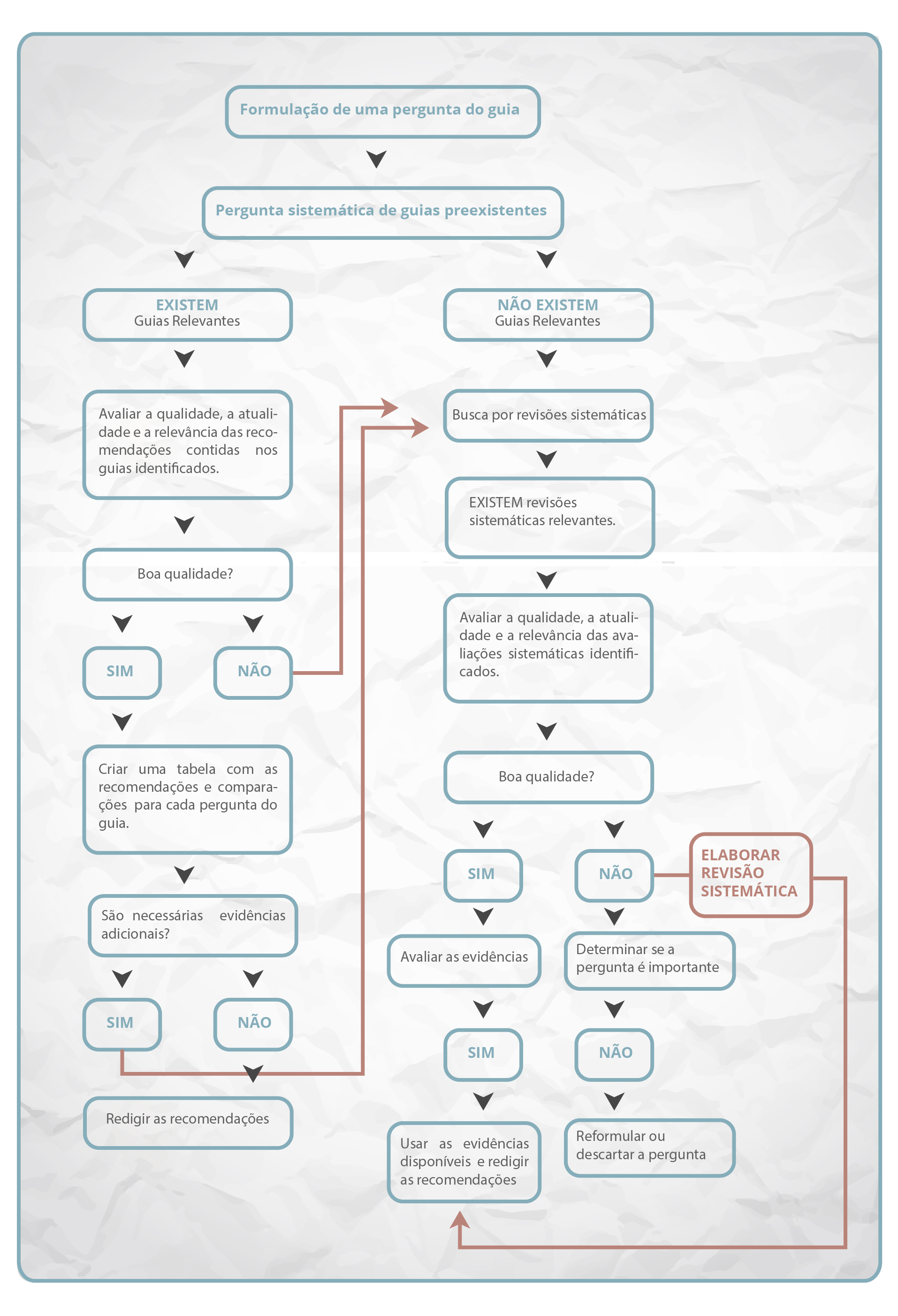
- Ao realizar a pesquisa hierarquizada, são detectados um ou mais guias de elevada qualidade metodológica, potencialmente relevantes, e que fornecem recomendações para perguntas desenvolvidas pelo painel de especialistas;
- A equipe de elaboração localiza guias potencialmente relevantes, mas de qualidade metodológica baixa;
- Não são localizados guias ou recomendações relevantes para as perguntas propostas pelo painel de especialistas.
- Nome do guia localizado, nome do órgão elaborador e data da elaboração do guia;
- Lista de recomendações contidas nos guias encontrados, de acordo com as perguntas propostas pelo painel;
- Avaliação da qualidade do guia conforme o instrumento AGREE II.
- Antman EM, Lau J, Kupelnick B, Mosteller F, Chalmers TC. A comparison of results of meta-analyses of randomized control trials and recommendations of clinical experts. Treatments for myocardial infarction. JAMA. 1992 Jul 8;268(2):240-8.
- Mulrow CD. Rationale for systematic reviews. BMJ. 1994 Sep 3;309(6954):597-9.
- WHO Library. Estonia Handbook for Guidelines Development. Geneva: WHO Press; 2011.
- Fervers B, Burgers J, Haugh M, Latreille J, Mlika-Cabanne N, Paquet L, et al. Adaptation of clinical guidelines: literature review and proposition for a framework and procedure. Int J Qual Health Care. 2006;18(3):167-76.
- AGREE Next Steps Consortium. El Instrumento AGREE II2009, de http://www.agreetrust.org; Versión en español: http://www.guiasalud.es.
- WHO Library. WHO handbook for guideline development. Geneva: WHO Press; 2012.
- Woolf SH. Practice guidelines, a new reality in medicine. II. Methods of developing guidelines. Arch Intern Med. 1992 May;152(5):946-52.
- Shea BJ, Grimshaw JM, Wells GA, Boers M, Andersson N, Hamel C, et al. Development of AMSTAR: a measurement tool to assess the methodological quality of systematic reviews. BMC Med Res Methodol. 2007;7:10.
- Shea BJ, Hamel C, Wells GA, Bouter LM, Kristjansson E, Grimshaw J, et al. AMSTAR is a reliable and valid measurement tool to assess the methodological quality of systematic reviews. J Clin Epidemiol. 2009 Oct;62(10):1013-20.
- Higgins JPT, Green S, Scholten RJPM. Chapter 3: Maintaining reviews: updates, amendments and feedback. In: Higgins JPT, Green S, editors. Cochrane Handbook for Systematic Reviews of Interventions Version 510 (updated March 2011): The Cochrane Collaboration; 2011.
- Wells GA, Shea B, O’Connell D, Peterson J, Welch V, Losos M, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in meta-analyses. Ottawa Hospital Research Institute; [cited 2012];
- Whiting PF, Rutjes AW, Westwood ME, Mallett S, Deeks JJ, Reitsma JB, et al. QUADAS-2: a revised tool for the quality assessment of diagnostic accuracy studies. Ann Intern Med. 2011 Oct 18;155(8):529-36.
- Higgins JP, Altman DG, Gotzsche PC, Juni P, Moher D, Oxman AD, et al. The Cochrane Collaboration’s tool for assessing risk of bias in randomised trials. BMJ. 2011;343:d5928.
- Hannes K. Chapter 4: Critical appraisal of qualitative research. In: Noyes J, Booth A, Hannes K, Harden A, Harris J, Lewin S, et al., editors. Supplementary Guidance for Inclusion of Qualitative Research in Cochrane Systematic Reviews of Interventions, Version 1 (updated August 2011): Cochrane Collaboration Qualitative Methods Group. ; 2011.
- Drummond M, O’ Brien B, Stoddart G, Torrance G. Methods for the Economic Evaluation of Health Care Programmes. Tercera ed: Oxford University Press; 2005.
Avaliação e adaptação de guias preexistentes
Como deve ser conduzido e relatado o processo de pesquisa da literatura?
Guias de prática clínica com base no consenso de especialistas, ou que utilizam métodos não sistemáticos para a pesquisa, seleção, avaliação e síntese das evidências disponíveis, têm sido questionados pelo alto potencial de viés e por conter recomendações que fogem do melhor e mais atualizado conhecimento científico (1, 2). Por essa razão, qualquer guia deve basear as suas recomendações em evidências científicas coletadas sistematicamente, isto é, de forma transparente e reproduzível.
Devido às limitações de tempo, recursos econômicos e humanos, entre outros, o processo de busca na literatura nem sempre perfaz a mesma cobertura e rigor esperada em revisões sistemáticas. No entanto, devem ser sempre respeitados os seguintes elementos-chave em uma busca sistemática:
Realizar um novo processo de busca da literatura e elaborar estratégias de pesquisa para cada uma das perguntas propostas pelo painel é uma tarefa complexa, onerosa, que demanda tempo e exige colaboradores familiarizados com o método usado em revisões sistemáticas. Por esse motivo, renomadas instituições elaboradoras de guias (SIGN, OMS) propõem concentrar a pesquisa de evidências em dois tipos de documentos:
Esse modelo hierárquico para conduzir a pesquisa por evidências científicas tem o seu fundamento na suposição de que o efeito de uma intervenção em termos de benefícios e riscos associados é, em geral, extrapolado globalmente. No entanto, os custos associados, os valores e as preferências dos pacientes, bem como a viabilidade em introduzir a recomendação, devem ser discutidos e documentados com evidências locais (3) (Figura 2).
Quais são os sites que disponibilizam guias de prática clínica? Como devem ser avaliadas a qualidade e a relevância de um guia quando se faz a adaptação de um guia preexistente?
Um número importante de agências e instituições em nível internacional tem publicado em seus sites na internet cópias para download (a maioria gratuitamente) dos guias por eles desenvolvidos (consultar o Quadro 8). A disponibilidade desses guias torna o processo de adaptação das recomendações um método eficiente que evita duplicar o trabalho já feito (4) (mais detalhes, ver em: https://www.g-i-n.net/).
|
Guidelines International Network |
Internacional | |
|
Guias da Organização Mundial de Saúde |
Internacional | |
|
Australian Government National Health |
Austrália | |
|
Australian Government National Health and Medical Research Council |
Austrália | |
|
Biblioteca de Guias de Prática Clínica do Sistema Nacional de Saúde, Espanha |
Espanha | |
|
Comissão Nacional de Incorporação de Tecnologias em Saúde no SUS - CONITEC |
Nacional | |
|
Finnish Current Care |
Finlândia | |
|
Geneva Foundation for Medical Education and Research |
Suíça | |
|
Agency for Healthcare Research and Quality |
Estados Unidos | |
|
Institute for Clinical Systems Improvement |
Estados Unidos | |
|
eGuidelines |
Reino Unido | |
|
National Institute for Health and Clinical Excellence |
Reino Unido | |
|
Canadian Agency for Drugs and Technologies in Health |
Canadá | |
|
Public Health Agency of Canada |
Canadá |
É importante que o processo de busca de guias seja documentado detalhadamente, a fim de garantir a transparência e a replicação dos resultados. Essa busca deve ser feita o mais amplamente possível, idealmente sem limitação de idioma, com definição das datas em que cada site foi acessado, dos termos de pesquisa utilizados e de quantos guias foram encontrados.
Nesse sentido, é possível que a equipe desenvolvedora de um guia se depare com três cenários possíveis:
Desse modo, surge a necessidade de um instrumento que permita a avaliação da qualidade do guia encontrado.
O instrumento AGREE II (5) é composto por 23 itens organizados em seis domínios: escopo e objetivo do guia; participação das partes interessadas; rigor na preparação; clareza; aplicabilidade; e independência editorial. Com o uso dessa ferramenta de comprovada confiabilidade e validade, é possível contar com uma estimativa da qualidade do guia em questão. Esse instrumento foi desenvolvido para ser aplicado genericamente em qualquer tipo de guia, independentemente do seu escopo (para baixar uma versão completa do instrumento AGREE II, visitar: https://www.agreetrust.org/.)
O painel de especialistas deve ter as seguintes informações quando é feita a adaptação de recomendações de guias preexistentes:
Caso seja detectado um guia desenvolvido recentemente, de alta qualidade e que tenha abordado todas as questões sugeridas pelo painel de especialistas, o processo de busca é finalizado, procedendo-se à adaptação das recomendações ao contexto local. Quando nem todas as perguntas do painel foram abordadas por guias preexistentes, ou a qualidade é duvidosa, faz-se necessário obter mais evidências em outras fontes.
A Colaboração ADAPTE define a adaptação de diretrizes como uma abordagem sistemática do uso e/ou modificação de diretriz(es) produzida(s) em um ambiente cultural e organizacional para a sua aplicação em um contexto diferente do original. A adaptação pode ser utilizada como uma alternativa ao desenvolvimento de novas diretrizes ou para adequar diretriz(es) existente(s) ao contexto local. O Ministério da Saúde define que as diretrizes externas selecionadas para a adaptação devem atender aos seguintes padrões mínimos: ausência de financiamento de fontes comerciais; existência de revisão sistemática da literatura; conflitos de interesse declarados e relatados; métodos de desenvolvimento da diretriz descritos no documento e semelhantes aos preconizados na sua diretriz metodológica para elaboração de diretrizes.
Há uma diretiz metodológica do Ministério da Saúde que aborda as ferramentas para adaptação de diretrizes clínicas, clique aqui para acessar.
Fontes de Informação para elaboração de guias
Quais são as fontes de informação mais importantes para o desenvolvimento de um guia?
No modelo de pesquisa hierarquizada, o próximo passo são as revisões sistemáticas. Esse tipo de estudo, quando conduzido com rigor, é considerado o elemento crucial para fundamentar as recomendações dos guias de prática clínica (6). Nesse sentido, a equipe elaboradora do guia deve ter experiência na busca e análise crítica desse tipo de estudo. As revisões sistemáticas são estudos de investigação científica, que seguem um processo explícito e reprodutível para identificar, avaliar e resumir todas as evidências disponíveis sobre a eficácia de uma intervenção (7). É importante saber diferenciar esse tipo de revisão daquelas revisões narrativas da literatura (Quadro 9).

Ao encontrar revisões sistemáticas na literatura pertinentes às perguntas que compõem o guia (sejam elas revisões sobre diagnóstico, tratamento ou prognóstico), deve-se avaliar a relevância, o rigor metodológico e a atualidade das informações. A relevância deve ser avaliada especialmente em relação aos componentes da pergunta PICO e sua semelhança com a revisão encontrada. É essencial avaliar também a qualidade metodológica da revisão sistemática, de modo a incluir no guia evidências provenientes de revisões de alta qualidade, com o menor risco de viés. Essa avaliação pode ser efetuada pelo instrumento AMSTAR (8, 9). Finalmente, é importante que as revisões encontradas sejam avaliadas em relação ao seu grau de atualização, analisando-se se há evidências disponíveis que, por terem sido publicadas mais recentemente, estão ausentes da revisão. Embora inexista uma estimativa de quantos anos depois de publicada uma revisão sistemática, ela é considerada obsoleta, a colaboração Cochrane recomenda avaliar se foram publicadas novas evidências após dois anos a contar da data da publicação da revisão (10).
Caso não tenha sido identificada nenhuma revisão sistemática sobre as questões do guia, devem ser usadas fontes primárias de informação, tais como ensaios clínicos randomizados, coortes, estudos de caso-controle, estudos transversais, entre outros. Assim como as outras evidências coletadas, é necessário que esses estudos sejam analisados criticamente antes de serem considerados para compor as recomendações.
|
Colaboração Cochrane |
|
|
Colaboração Campbell |
|
|
PubMed (MEDLINE) |
|
|
CINAHL |
https://www.ebscohost.com/nursing/products/cinahl-databases/cinahl-complete |
|
EMBASE |
|
|
LILACS |
|
|
Clinical Evidence |
|
|
McMaster Premium Literature Service |
http://hiru.mcmaster.ca/hiru/HIRU_McMaster_PLUS_Projects.aspx |
|
International Network of Agencies for Health Technology Assessment |
|
|
International Health Economics Association |
|
|
Health Evidence |
|
|
PDQ-Evidence |
Qual delineamento deve ser considerado para responder a perguntas específicas de etiologia, diagnóstico, terapia, prevenção e prognóstico?
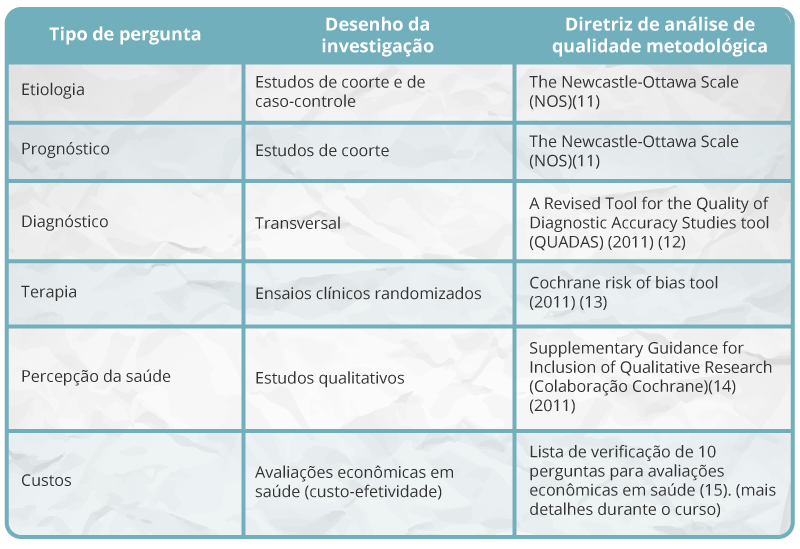
Quando for impraticável otimizar o processo de busca com base nos guias existentes e revisões sistemáticas, a equipe de elaboração deve recorrer a estudos primários. Nesse sentido, é necessário selecionar o desenho de estudo mais adequado para documentar com evidências cada pergunta do guia. No Quadro 11 é sugerido o delineamento que melhor fundamenta cada uma das áreas em questão. Da mesma forma, são mostrados alguns dos muitos instrumentos, bem como checklists disponíveis na literatura, que são utilizados para analisar a qualidade metodológica desses estudos. Uma vez que a disponibilidade de certos tipos de estudo varia de acordo com a área avaliada, os elaboradores de um guia precisam ser criteriosos ao fundamentar uma recomendação com um delineamento inadequado.
Como deve ser realizado e relatado o processo de seleção das evidências?
Em seções anteriores, insistiu-se na importância de relatar a pesquisa de evidências realizada de modo transparente e explícito. Após ter levantado todas as evidências disponíveis, estas devem ser selecionadas de acordo com critérios de inclusão e exclusão preestabelecidos pela equipe elaboradora. É necessário que esses critérios de seleção estejam em sintonia com as perguntas clínicas preparadas pelo painel de especialistas (formato PICO). As razões pelas quais certos artigos foram excluídos devem ser documentadas em anexos ou material suplementar. Idealmente, esse processo tem de ser realizado em pares e de forma independente. Qualquer desacordo entre os avaliadores será esclarecido com uma discussão dos pontos de vista (consenso) ou a arbitragem de um terceiro membro do grupo.
Quais são as estratégias de síntese das evidências disponíveis?
Após a seleção das evidências disponíveis, estas devem ser sintetizadas para exposição junto ao painel de especialistas. O uso de tabelas de evidências de acordo com o tipo de estudo, sejam guias, revisões sistemáticas ou estudos primários, facilita esse processo. As tabelas das recomendações provenientes de guias preexistentes precisam relatar o nome, o ano de publicação, a recomendação correspondente à pergunta clínica, acompanhada das evidências que apoiam a recomendação e o resultado da análise crítica conforme o instrumento AGREE II. Quando se trata de sintetizar os resultados de revisões sistemáticas, é recomendável que sejam apresentados por perfis de evidências GRADE (mais detalhes durante o curso). No caso de estudos primários, recomenda-se que sintetizem aspectos-chave relacionados a questões clínicas, de acordo com o formato PICO (Paciente ou população, intervenção ou exposição, comparação, desfecho - outcome).